Creado por el Dr. Oscar Gershanik, apoyad o por el Dr. Francisco Stefano, en el año 1985 con el objetivo de abordar desde la experimentación
o por el Dr. Francisco Stefano, en el año 1985 con el objetivo de abordar desde la experimentación
básica problemas relevantes a la fisiopatología y el tratamiento de la Enfermedad de Parkinson (EP). Actualmente centramos nuestras líneas de investigación en comprender los mecanismos moleculares, estructurales y fisiológicos que determinan los efectos adversos asociados al tratamiento con Levodopa, principalmente el desarrollo de disquinesias. Utilizamos modelos de disquinesias en ratones salvajes, knock-out y transgénicos, combinados con técnicas de biología molecular, bioquímica e histología. Asimismo, estudiamos los mecanismos celulares implicados con la muerte y sobrevida de las neuronas dopaminérgicas.
OBJETIVOS
Nuestro objetivo último es que el conocimiento producido en nuestro laboratorio tenga un impacto directo para mejorar la calidad de vida de los enfermos de Parkinson.
INTEGRANTES
Director
OSCAR SAMUEL GERSHANIK
Investigador Concurrente
Investigadores
Investigador Adjunto - Carrera del Investigador Científico y Tecnológico del CONICET.
Investigadora Adjunto - Carrera del Investigador Científico y Tecnológico del CONICET. (Lugar de trabajo: Universidad Nacional de Entre Rios)
Investigadora Asistente - Carrera del Investigador Científico y Tecnológico del CONICET.
Becarios Posdoctorales
Becaria postdoctoral CONICET
Becaria postdoctoral CONICET
Becarios Doctorales
PEDRO BALLESTERO
Estudiante de doctorado: Universidad de Buenos Aires, Becario doctoral CONICET (2018)
ANA DAMIANICH
(Director de Tesis, Elena AVALE, INGEBI, Codireccion, Juan Ferrario y Oscar Gershaik).
Estudiante de doctorado: Universidad de Buenos Aires, Facultad de Cs Exactas y Naturales. Becaria doctoral CONICET
Estudiantes de tesis de grado
LUCIANA ISAJA
Licenciatura en Ciencias Biológicas, FCEN, UBA
TOMAR EIDELMAN
Licenciatura en Ciencias Biológicas, FCEN, UBA
LINEAS DE INVESTIGACIÓN
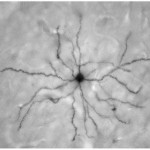 ESTUDIO DE LOS MECANISMOS QUE SUBYACEN AL DESARROLLO DE MOVIMIENTOS ANORMALES INDUCIDOS POR FÁRMACOS.
ESTUDIO DE LOS MECANISMOS QUE SUBYACEN AL DESARROLLO DE MOVIMIENTOS ANORMALES INDUCIDOS POR FÁRMACOS.
El desarrollo de movimientos anormales es una complicación frecuente en la terapéutica crónica de enfermedades neurológicas y psiquiátricas, como la enfermedad de Parkinson y la esquizofrenia. Una vez instalado este efecto adverso de la medicación, es sumamente difícil de revertir, presumiblemente por la instalación de cambios de larga duración, estructurales y funcionales, en los circuitos de los ganglios de la base. El objetivo general de este proyecto es estudiar las adaptaciones plásticas estructurales y funcionales subyacentes al desarrollo de movimientos involuntarios anormales inducidos por fármacos. Para ello, utilizamos como modelos animales las “disquinesias inducidas por L-DOPA” en animales con lesión de la vía dopaminérgica nigroestriatal y las “disquinesias tardías inducidas por antipsicóticos”. Particularmente estudiamos los cambios plásticos a nivel estructural en las neuronas estriatales inducidos por la desnervación dopaminérgica con 6-OHDA y el tratamiento crónico con L-DOPA en ratones transgénicos mediante el análisis morfológico del árbol dendrítico y la determinación del número de espinas dendríticas. Seguidamente evaluamos si el remodelado dendrítico estructural está acompañado de cambios plásticos funcionales mediante métodos optogenéticos. El esclarecimiento de los mecanismos patofisiológicos básicos que participan en el desarrollo de movimientos anormales podría contribuir al desarrollo de novedosas intervenciones terapéuticas y tener así un impacto directo en la calidad de vida de los enfermos.
VALIDACIÓN DE FYN COMO BLANCO FARMACOLÓGICO PARA EL CONTROL DE DISQUINESIAS INDUCIDAS POR LEVODOPA
Controlar las disquinesias inducidas por levodopa (LID) es uno de los grandes desafíos en el tratamiento de la EP. Varios cambios genéticos y bioquímicos fueron asociados con el fenómeno y varias evidencias apuntan a la zona de densidad postsináptica de las neuronas estriatales que contienen el receptor dopaminérgico D1 como un lugar central donde ocurre un rearreglo plástico anormal que desencadenaría la aparición LID. Postulamos que la proteína quinasa Fyn es un intermediario clave de este proceso. Fyn media la fosforilación del receptor NMDA inducida por el receptor D1 y PSD-95 regulando su localización intracelular. Fyn participa en la inducción de LTP y LTD como también en los procesos de memoria y aprendizaje y en mecanismos de adicción. A pesar de la gran cantidad de funciones atribuidas a Fyn en la postsinapsis del receptor D1, hasta el momento no ha sido asociado con disquinesias. Recientemente hemos reproducido el modelo de disquinesias en ratones carentes de Fyn (KO-Fyn), demostrando una menor capacidad de estos ratones a desarrollar LID. Actualmente trabajamos para profundizar en la participacion de Fyn y en la mecanística de este proceso complementando con el análisis postmortem de moléculas asociadas en disquinesias como pERK, FosB/ΔfosB y Arc.
CONTRIBUCIÓN DE LAS INTERNEURONAS ESTRIATALES AL DESARROLLO DE DISQUINESIAS INDUCIDAS POR L-DOPA
Concomitante al desarrollo de disquinesias inducidas por L-DOPA (LID) en los últimos años se han reportado cambios en las interneuronas estriatales, las cuales no solo regulan localmente el disparo de las neuronas de proyección, sino que también producen factores tróficos que podrían participar en la modulación de los cambios plásticos ya reportados.
Aunque éstas constituyen sólo un 5% de las neuronas estriatales, es ampliamente aceptado que las interneuronas estriatales poseen un rol central en el control de los movimientos voluntarios y en la patofisiología de desórdenes del movimiento, como la EP, Enfermedad de Huntington y distonías, pero poco se sabe aún de los cambios que ocurren en estas poblaciones bajo el contexto de depleción dopaminérgica y administración crónica de L-DOPA; y cómo estos cambios contribuyen al desarrollo o mantenimiento de las LID. Esta línea de investigación busca caracterizar los cambios que ocurren en los distintos tipos de interneuronas estriatales en el modelo en ratón de LID, y evaluar su rol funcional en el desarrollo y/o mantenimiento de las disquinesias.
MECANISMOS MOLECULARES Y DISECCIÓN NEURONAL DE SEÑALIZACIÓN INTRACELULAR INVOLUCRADAS EN DISQUINESIAS INDUCIDAS POR LEVODOPA.
El objetivo general de esta linea de investigación es estudiar los mecanismos celulares y moleculares implicados en el desarrollo de las disquinesias inducidas por el tratamiento con L-DOPA en modelos experimentales de la EP. Los Objetivos específicos de este trabajo son los siguientes: 1. Disecar el papel de las vías D1 y D2 en el desarrollo de disquinesias en modelos animales de la EP. Esto se realizará mediante la técnica de separación de células fluorescentes (FACS) D1 y D2 obtenidas de tejido de ratones transgénicos D1-TOM/D2-GFP a los que se induzca disquinesias mediante L-DOPA. 2. Estudiar, para cada tipo celular (D1, D2) los cambios en la expresión génica y el estado de fosforilación de diferentes moléculas implicadas en disquinesias, con particular interés en la participación de Fyn, CaMKII, las subunidades NR2A y NR2B, y las moléculas participantes en esta cascada de señalización. Este objetivo se abordará mediante dos procedimientos experimentales: histología de los tejidos para localizar la expresión molecular en cada vía mediante inmunofluorescencia; Técnicas de Biología Molecular (Western Blot y qPCR) en las células separadas por FACS para la identificación de expresión y fosforilación de las proteínas objeto de estudio. 3. Demostrar el rol funcional de las moléculas implicadas en disquinesias para cada una de las vías D1 y D2. Para ello se procederá al silenciamiento mediante shRNA de los genes que tengan un rol importante en las distintas vías según los objetivos obtenidos en los resultados previos. Este proyecto aspira a descifrar las vías de señalización involucradas en el desarrollo de disquinesias con el fin de sentar las bases a nuevas intervenciones terapéuticas, y se cuenta con el conocimiento y las herramientas apropiadas para afrontar su estudio.
PARTICIPACIÓN DE LA ACTIVIDAD NEURONAL EN LA SOBREVIDA DE LAS NEURONAS DOPAMINÉRGICAS
Las neuronas dopaminérgicas (DA) son más sensibles a la degeneración que otras neuronas del sistema nervioso. Esta característica puede reproducirse en cultivos primarios mesencefálicos donde, en condiciones particulares, las neuronas DA mueren en un lapso de 7 a 14 días, mientras que otros tipos neuronales no. Esta particularidad del cultivo lo convierte en un interesante modelo para estudiar mecanismos de neuroprotección para las neuronas DA.
Se ha demostrado que ciertas condiciones farmacológicas, la despolarización favorece la sobrevida neuronal, como también la estimulación de su actividad mediante nicotina, y por lo tanto se postula que esto podría deberse a las propiedades eléctricas particulares de este tipo de neuronas. Nuestra hipótesis es que una mayor actividad eléctrica tiene un efecto neuroprotector. Para evaluarlo estamos evaluando herramientas moleculares capaces de aumentar la actividad eléctrica de manera controlada, como ser receptores artificiales estimulables por la luz (Chanelrodhopsine) y por fármacos específicos (DREADD). Asimismo estamos investigando la plasticidad eléctrica de este tipo de neuronas.
PUBLICACIONES DESTACADAS
Contrasting gene expression patterns induced by levodopa and pramipexole treatments in the rat model of Parkinson's disease. Taravini IR, Larramendy C, Gomez G, Saborido MD, Spaans F, Fresno C, González GA, Fernández E, Murer MG, Gershanik OS. Neuropharmacology. 2015 May 9. pii: S0028-3908(15)00147-1. doi: 10.1016/j.neuropharm.2015.04.018
Pleiotrophin over-expression provides trophic support to dopaminergic neurons in parkinsonian rats. Taravini IR, Chertoff M, Cafferata EG, Courty J, Murer MG, Pitossi FJ, Gershanik OS. Mol Neurodegener. 2011 Jun 7;6:40. doi: 10.1186/1750-1326-6-40.
Cabergoline and pramipexole fail to modify already established dyskinesias in an animal model of parkinsonism. Larramendy C, Taravini IR, Saborido MD, Ferrario JE, Murer MG, Gershanik OS. Behav Brain Res. 2008 Dec 1;194(1):44-51. doi: 10.1016/j.bbr.2008.06.021. Epub 2008 Jun 27.
Mapping the effects of three dopamine agonists with different dyskinetogenic potential and receptor selectivity using pharmacological functional magnetic resonance imaging. Delfino M, Kalisch R, Czisch M, Larramendy C, Ricatti J, Taravini IR, Trenkwalder C, Murer MG, Auer DP, Gershanik OS. Neuropsychopharmacology. 2007 Sep;32(9):1911-21. Epub 2007 Feb 7.
Immunodetection of heparin-binding growth associated molecule (pleiotrophin) in striatal interneurons. Taravini IR, Ferrario JE, Delbe J, Ginestet L, Debeir T, Courty J, Murer MG, Gershanik OS, Raisman-Vozari R. Brain Res. 2005 Dec 20;1066(1-2):196-200. Epub 2005 Dec 2.
Differential gene expression induced by chronic levodopa treatment in the striatum of rats with lesions of the nigrostriatal system. Ferrario JE, Taravini IR, Mourlevat S, Stefano A, Delfino MA, Raisman-Vozari R, Murer MG, Ruberg M, Gershanik O. J Neurochem. 2004 Sep;90(6):1348-58.
Behavioral sensitization to different dopamine agonists in a parkinsonian rodent model of drug-induced dyskinesias. Delfino MA, Stefano AV, Ferrario JE, Taravini IR, Murer MG, Gershanik OS. Behav Brain Res. 2004 Jul 9;152(2):297-306.
Effects of orally administered levodopa on mesencephalic dopaminergic neurons undergoing a degenerative process. Ferrario JE, Delfino MA, Stefano AV, Zbarsky V, Douhou A, Murer MG, Raisman-Vozari R,Gershanik OS. Neurosci Res. 2003 Dec;47(4):431-6.
Increased [125I]sulpiride binding in the subthalamic nucleus of rats with nigrostriatal lesions. Murer MG, Ferrario J, Delfino M, Dziewczapolski G, Gershanik OS, Raisman-Vozari R. Neuroreport. 1999 May 14;10(7):1501-5.
FUENTES DE FINANCIAMIENTO
Internacionales
MICHAEL J FOX FOUNDATION FOR PARKINSON'S RESEARCH. TARGET VALIDATION SPRING 2014. (Agosto 2014 a Marzo 2017). La quinasa Fyn como candidata en la mediación de la reorganización postsináptica anormal en las disquinesias inducidas por Levodopa. (Titulo original: “The kinase Fyn as a candidate mediating abnormal postsynaptic reorganization in Levodopa induced dyskinesias (LID).” Grupo Responsable: Oscar Gershanik y Juan Ferrario (Codirectores).
Dra. Sara Sanz-Blasco
Return Home Award. Committee for Aid and Education in Neurochemistry, International Society for Neurochemistry. Junio 2014.
Nacionales
FINANCIAMIENTO PARA EL CAMBIO DE LUGAR DE TRABAJO Y RADICACIÓN DE INVESTIGADORES DE CONICET (2013-2014). Para radicación de la Dra. Irene Taravini en la Facultad de Bromatología, Universidad Nacional de Entre Ríos (UNER), Gualeguaychú. I. Responsable: Dra. Irene Taravini.
CONICET. PIP-112-201201-00401. 2013-2015. “CAMBIOS ESTRUCTURALES Y FUNCIONALES EN EL ESTRIADO DE ANIMALES PARKINSONIANOS QUE DESARROLLAN DISQUINESIAS”. Director Dr. Mariano Belluscio. MIEMBRO DEL GRUPO RESPONSABLE. Grupo responsable: Dr. Mariano Belluscio, Dr. Juan Ferrario y Dra. Irene Taravini.
Agencia de Promoción Científica y Tecnológica - PICT-2011-1758 (dic 2012-dic 2015) - “ESTUDIO DE LA PLASTICIDAD ESTRUCTURAL Y MOLECULAR INVOLUCRADA EN EL DESARROLLO DE DISQUINESIAS INDUCIDAS POR L-DOPA EN LA ENFERMEDAD DE PARKINSON”. Monto asignado $ 300.000. Grupo Responsable: Dr. Oscar Gershanik. Campo de aplicación: Neurofarmacología de la Enfermedad de Parkinson. Administrador: INNOVAT.
COLABORACIONES
Nacionales
Dr. Gustavo Murer, Laboratorio de Fisiología de Circuitos Neuronales, Instituto de Fisiología y Biofísica (IFIBIO Houssay), CONICET y Facultad de Medicina, Universidad de Buenos Aires.
Dra. Elena Avale, INGEBI, CONICET (Colaborador subsidio Fox Foundation)
Dr. Juan Belforte, Instituto de Fisiología y Biofísica (IFIBIO Houssay), CONICET y Facultad de Medicina, Universidad de Buenos Aires.
Dr. Mariano Belluscio, Facultad de Medicina, UBA (Titular subsidio PIP2012)
Internacionales
Dra. Rita Raisman-Vozari, Hopital de la Pitie-Salpetriere, Paris, Francia
Dra. Diane Hanger, King´s College London, Institute of Psychiatry, Psychology & Neuroscience, London, UK
Dres. Juan Burrone and Mathew Grubb, King’s College London, MRC Centre for neurodevelopmental Biology, London, UK